Pengertian dan Definisi Konfigurasi Elektron. Konfigurasi Elektron adalah susunan elektron-elektron pada sebuah atom. Susunan elektron pada sebuah atom tidak sembarangan tetapi mengikuti pola atau rumus atau kaidah tertentu yang telah di tetapkan oleh para ahli kimia yang khusus mempelajari tentang konfigurasi elektron. Pada Ilmu Kimia, diterapkan tiga aturan dasar atau azas penting yang menjadi dasar penyusunan konfigurasi elektron suatu atom yaitu prinsip Aufbau, kaidah Hund dan larangan Pauli. Masing-masing prinsip ini menjelaskan tentang konfigurasi elektron yang mungkin terjadi pada suatu atom dengan peraturan-peraturan yang mengikat dan harus terpenuhi.
Konfigurasi elektron pertama kali muncul saat Niels Bohr, pada tahun 1923 mengajukan teori bahwa periodisitas pada sifat-sifat unsur kimia dapat dijelaskan oleh struktur elektronik atom yang bersangkutan. Teori ini didasarkan pada model atom Bohr. Pada saat itu, Bohr telah mencetuskan teori konfigurasi elektron yang memang sangat berbeda dengan yang ada sekarang. Banyak sekali kelemahan yang menyebabkan konfigurasi elektron Bohr tidak di gunakan salahsatunya adalah sistem konfigurasi atom Bohr tidak dapat menjelaskan perubahan spektra atom dalam medan magnet. Sistem konfigurasi elektron Bohr kemudian di kaji ulang oleh Wolfgang Pauli hingga kemudian tercetuslah teori larangan pauli.
 Seperti halnya partikel elementer lainnya, elektron juga mempunyai sifat-sifat partikel dan gelombang serta harus patuh pada hukum mekanika kuantum. Elektron dapat berpindah dari satu atom ke atom yang lain dengan mengeluarkan energi atau emisi dalam bentuk foton. Selain berpindah, satu elektron juga bisa di gunakan oleh atom yang berbeda sehingga terbentuk suatu ikatan kimia. Konfigurasi elektron mempunyai notasi yang bersifat universal sehingga bisa di mengerti oleh siapa saja dan dimana saja. Notasi konfigurasi elektron ini berhubungan dengan untaian label orbital atom yang diberi label dengan hurup s, p, d, f, g, h,…. Setiap notasi berisi jumlah atom dan label orbitalnya.
Seperti halnya partikel elementer lainnya, elektron juga mempunyai sifat-sifat partikel dan gelombang serta harus patuh pada hukum mekanika kuantum. Elektron dapat berpindah dari satu atom ke atom yang lain dengan mengeluarkan energi atau emisi dalam bentuk foton. Selain berpindah, satu elektron juga bisa di gunakan oleh atom yang berbeda sehingga terbentuk suatu ikatan kimia. Konfigurasi elektron mempunyai notasi yang bersifat universal sehingga bisa di mengerti oleh siapa saja dan dimana saja. Notasi konfigurasi elektron ini berhubungan dengan untaian label orbital atom yang diberi label dengan hurup s, p, d, f, g, h,…. Setiap notasi berisi jumlah atom dan label orbitalnya.
Konfigurasi elektron menggambarkan penyebaran atau susunan elektron dalam atom. Pengisian elektron pada kulit-kulit atom memenuhi aturan-aturan tertentu, yaitu:
a. Jumlah maksimum elektron pada suatu kulit memenuhi rumus 2n2, dengan n = nomor kulit
- Kulit K (n = 1) maksimum 2 . 12 = 2 elektron
- Kulit L (n = 2) maksimum 2 . 22 = 8 elektron
- Kulit M (n = 3) maksimum 2 . 32 = 18 elektron
- Kulit N (n = 4) maksimum 2 . 42 = 32 elektron, dan seterusnya.
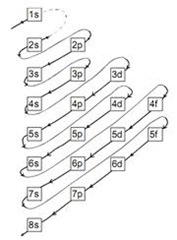
b. Pengisian elektron pada orbital suatu atom di mulai dari orbital yang paling rendah
- s adalah label orbital paling rendah
- p adalah label orbital ke dua
- d adalah label orbital ke tiga
- f adalah label orbital ke empat, dan seterusnya
c. Jumlah maksimum elektron pada kulit terluar adalah 8
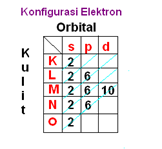
Contoh Konfigurasi elektron unsur Stronsium (Sr). Sr mempunyai no Atom 38. Maka konfigurasi elektronnya adalah sebagai berikut:
Notasi Konfigurasi elektron Sr (Stronsium) dengan nomor atom 38 adalah sebagai berikut: 1s2 2s2 2p6 3s2 3p63d10 4s24p65s2 . Artinya:
- 1. Kulit pertama (K) berisi 2 elektron pada orbital s
- 2. Kulit kedua (l) berisi 8 elektron, 2 pada orbital s dan 6 pada orbital p
- 3. Kulit ketiga (M) berisi 18 elekton, 2 pada orbital s, 6 pada orbital p dan 10 pada orbital d.
- 4. Kulit keempat berisi 10 elektron, 2 pada orbital s, 6 pada orbital p,
- 5. Kulit kelima berisi 2 elektron yaitu pada orbital s